Medical Devices – rekisteröinti ja markkinoille saattaminen for Dummies | Osa 3
Asetin itselleni haasteen – kirjoittaa lääkinnällisten laitteiden rekisteröinnistä mahdollisimman kansantajuisesti, mainitsematta sanallakaan sitä asetus-, direktiivi-, lainsäädäntö ja standardiviidakkoa, joka toimialaan liittyy. Olen nimittäin kouluttaessani huomannut, että näiden luetteleminen voi vaikeuttaa asian sisäistämistä ja suosittelenkin hyppäämään itse lainsäädännön kimppuun vasta, kun perusteet ovat kunnossa. Toimikoon tämä blogautus siis yleistajuisena perusteoksena.
Tämän kolmiosaisen blogisarjan viimeisessä osassa viedään tuote markkinoille. Se käy näin:
10 ASKELTA MARKKINOILLE TUOMISEEN
7. Seuraa sopivaa vaatimuksenmukaisuuden arviointimenettelyä
Vaatimustenmukaisuudenarviointimenettely. Jos opettaisin jollekin vieraskieliselle suomea, pitäisin tämän sanan kirjoitusasun, ääntämisen ja merkityksen omaksumista riittävänä kriteerinä kiitettävään osaamisen tasoon. Englanniksi termi on ymmärrettävämpi: Conformity Assesment Route.
Käytännössä tämä tarkoittaa sitä, että osallistuuko tuotteen vaatimustenmukaisuuden arviointiin ulkopuolinen taho ja jos osallistuu, miten vaatimustenmukaisuus käytännössä osoitetaan. Keskeinen toimija vaatimustenmukaisuuden arvioinnissa on nk. Ilmoitettu laitos (Notified body), jonka kansallinen viranomainen (Suomessa Valvira) on kelpuuttanut arviointeja tekemään. Hyväksytystä arvioinnista ilmoitettu laitos myöntää EY-todistuksen (EC-Certificate), joka on voimassa aina 5 vuotta kerrallaan, mutta aivan niin vähällä valmistaja ei pääse: vaatimustenmukaisuuden arviointi pitää sisällään myös vuosittaisen seuranta-auditoinnit sekä ilmoittamattomat ylläripylläriauditoinnit.
Suomessa ilmoitettuja laitoksia on kaksi, SGS Fimko ja VTT Expert Services, jotka molemmat ovat laadukkaita ja arvostettuja toimijoita. Valmistaja voi kuitenkin valita kumppanikseen minkä hyvänsä EU-alueella toimiva ilmoitetun laitoksen, ja usein valinta onkin järkevää tehdä sen mukaan, mikä ilmoitettu laitos on soveltuvin arvioimaan juuri sinun tuotettasi. Monessa tapauksessa taas tuotteen tietyt ominaisuudet (esim. nanomateriaalit) ohjaavat ilmoitettujen laitosten valintaa, sillä kullakin NB:llä on omat osaamisalueensa, jonka puitteissa ne toimivat.
Lopullinen arviointireitin valinta riippuu olennaisesti tuotteen luokasta. Matalimman luokan MD- ja IVD-laitteille ainoa reitti on itseilmoitus (self declarance), eikä ilmoitettu laitos edes suostu näitä arvioimaan. Im ja Is –luokissa ilmoitettu laitos puolestaan arvioi ainoastaan tuotteen mittaustoimintoon (Im) tai steriilisyyteen (Is) liittyviä menetelmiä ja osoituksia. Korkeammissa tuoteluokissa (IIa, IIb, III) taas vaihtoehtoina on aina täydellisen laadunhallintajärjestelmän arviointireitti, tai luokasta riippuen sen tiettyjen osien arviointi, tai tuote-eräkohtainen hyväksyntä. Käytännössä täydellisen laadunhallinnan reitti on useissa tapauksissa ainoa järkevä ja usein kaikista selkein vaihtoehto.
Laadunhallintajärjestelmän ei tarvitse olla monimutkainen ja raskas, jos organisaatiokin on yksinkertainen. Minimitaso riittää aivan hyvin, ei ole mitään syytä puskea rimaa korkeammalle kuin on tarpeen. Liian raskas laadunhallintajärjestelmä voi halvauttaa yrityksen toimintaa, kun taas oikein mitoitettu ja hyvin laadittu laadunhallintajärjestelmä on liiketaloudellisesti järkevä sijoitus ja erinomainen johtamisen työkalu. Myös tässä kannattaa huomioida yrityksen strategiset tavoitteet ja jatkuva due diligence –valmius.
Riippumatta tuoteluokasta ja valitusta vaatimustenmukaisuuden arviointireitistä, hyvin laadittu ja oikein mitoitettu laadunhallintajärjestelmä on aina sijoitus, joka kannattaa!
8. Laadi vaatimuksenmukaisuusvakuutus ja tee CE-merkintä
Nyt ollaan jo pitkällä, market entry häämöttää jo kulman takana ja ensimmäisiä kuohujuomia voi jo jääkaappiin nostella. Ennen varsinaista markkinoille saattamista on kuitenkin vielä pari muodollista seikkaa edessä.
EY-vaatimustenmukaisuusvakuutus on menettely, jolla valmistaja vakuuttaa direktiivin/asetuksen vaatimusten täyttyvän. Vakuutuksessa listataan kaikki valmistajan tuotteet yksilöityine tuotenimineen sekä niiden tuoteluokat. Lisäksi vakuutuksessa on hyvä mainita, mitä standardeja noudattaen (kokonaan tai osittain) tuote/tuotteet on valmistettu ja, mikäli arviointiin on osallistunut ilmoitettu laitos, ilmoitetaan vakuutuksessa myös ilmoitetun laitoksen nimi ja numero. Vaatimustenmukaisuusvakuutuksen allekirjoittaa yleensä toimitusjohtaja.
Tämän jälkeen vuorossa onkin sitten juhlava CE-merkin kiinnittäminen. Saamme muuten säännöllisesti kyselyitä siitä, että saako meiltä CE-merkkejä, tai että mistä niitä voi hakea. Korostan vielä, että lääkinnällisissä laitteissa kyseessä ei siis ole hyväksyntä-, vaan arviointimenettely. Tuotteisiin ei myöskään liity minkäänlaista myyntilupamenettelyä, kuten monesti näkee esitettävän. Ilmoitettu laitos ei siis myönnä CE-merkkiä, vaan ainoastaan arvioi, että täyttyvätkö merkinnän edellytykset. CE-merkillä siis valmistaja itse vakuuttaa, että tuote täyttää lainsäädännön vaatimukset. Vastaavasti kuluttajan tai tuotteen loppukäyttäjän on CE-merkinnän nähdessään pystyttävä luottamaan, että tuote soveltuu käyttötarkoitukseensa ja on turvallinen.
Varsinaiset ohjeet CE-merkintään löytyvät muuten direktiivien vihoviimeisestä liitteestä ja ne kuuluvat näin:
CE-vaatimustenmukaisuusmerkintä koostuu kirjaimista ”CE” seuraavalla tavalla kirjoitettuina:
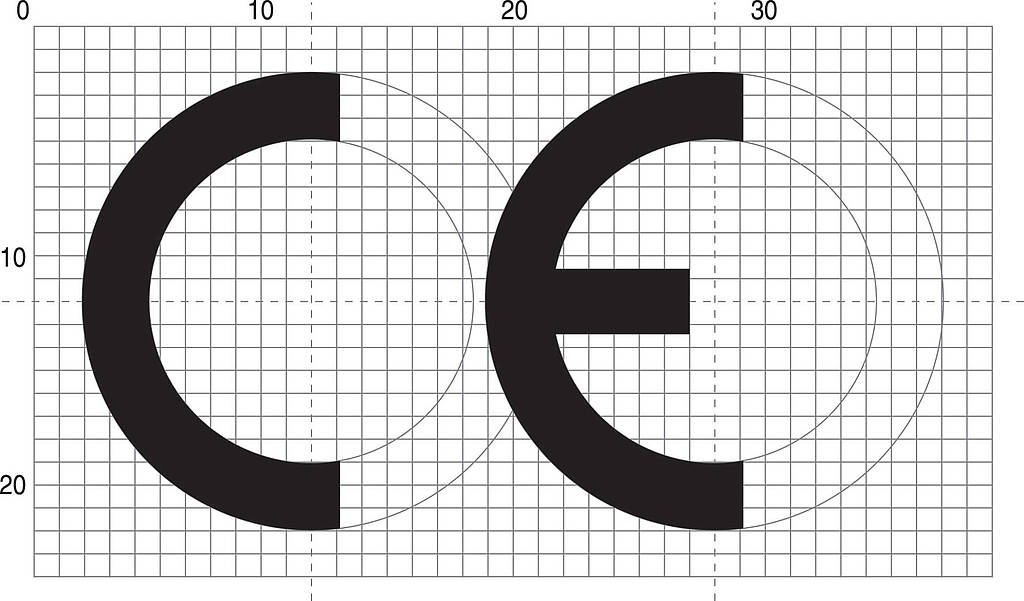
Jos merkintää pienennetään tai suurennetaan, on noudatettava edellä esitetyn kirjoitustavan mittasuhteita. CE-merkinnän eri tekijöiden on oltava selvästi samankorkuisia, kuitenkin vähintään 5 mm. ?Tämä vähimmäiskoko ei ole pakollinen pienille laitteille.
CE-merkintä on valmistajan vakuutus siitä, että lainsäädännön vaatimukset täyttyvät. Valmistaja itse painaa/kiinnittää merkin tuotteeseen, pakkaukseen, käyttöohjeisiin jne huolehtien, että edellä esitetyt mittasuhteet säilyvät.
9. Tee laiterekisteröinti Valviralle
Mikäli tuotteesi kuuluu alimpaan riskiluokkaan, voit rekisteröidä tuotteen heti kun katsot sen täyttävän edellä kuvatut vaatimukset. Mikäli tuoteluokka on korkeampi, voit rekisteröidä tuotteen, kun ilmoitettu laitos on sen arvioinut, kuten edellä on kuvattu.
Valmistaja rekisteröi tuotteet sen maan viranomaiselle, jossa sen kotipaikka sijaitsee, eli suomessa Valviralle. Varsinainen laiterekisteröinti on lopulta vain hallinnollinen toimenpide. Tarkemmat ohjeet ja rekisteröintilomake löytyy Valviran kotisivuilta.
Ennen rekisteröintiä tarvitset kuitenkin tuotteellesi vielä GMDN-koodin (Golbal Medical Device Nomenclature), jonka voi hakea järjestön sivuilta osoitteesta https://www.gmdnagency.org/. Palvelu on maksullinen, mutta jos tänne asti olet jo ansiokkaasti selvinnyt, ei se kohtuuttoman isoa lovea koko kehityksen budjettiin tee. Lisäksi rekisteröintilomakkeessa kysytään muita tuotteeseen liittyviä perustietoja, eli mitään dokumentaatiota tai todistuksia ei viranomaiselle tarvitse lähettää.
Laiterekisteröinti-ilmoitus on hallinnollinen toimenpide, eikä viranomainen systemaattisesti arvioi tehtyjä rekisteri-ilmoituksia.
10. Vie tuote markkinoille
Mahtavaa, nyt tuote on valmis (ja kelvollinen) vietäväksi markkinoille missä hyvänsä EU/ETA-maassa!
Ei tämä loppujen lopuksi mitään rakettitiedettä ole, mutta toki lainsäädäntö asettaa omat kiemuransa. Yksin näitä ei kuitenkaan kenenkään tarvitse pohtia, vaan Suomesta löytyy läjäpäin kovan luokan osaajia, jotka ovat sinua tässä valmiita auttamaan. Erityismaininnan haluan antaa myös Valviralle ja sen henkilöstön erinomaiselle palveluasenteelle. Käänny siis rohkeasti esimerkiksi Kasven asiantuntijoiden, ilmoitetun laitoksen tai vaikka Valviran puoleen, jos nämä asiat askarruttavat. Mikäli yrityksesi on Terveysteknologia ry:n jäsen (mitä voimakkaasti suosittelen), saat apua taatusti myös järjestön asiantuntijoilta sekä muilta jäsenyrityksistä. Apua siis löytyy varmasti, sen takaan!
Muista, jos nämä asiat askarruttavat, apua on aina saatavilla. Niin viranomainen, ilmoitetut laitokset kuin asiantuntijapalveluyrityksetkin auttavat sinua mielellään. Kysyvä ei tieltä eksy!
Lopuksi
Jos kotona vähän ja pyörittelet tavaroita, huomaat pian, että samanlainen CE-merkintä tulee vastaan monessa muussakin tuoteryhmässä: sähkölaitteissa, leluissa, työkaluissa, rakennusmateriaaleissa, turvavarusteissa… Yhteistä näillä kaikilla on se, että lainsäätäjä haluaa tällä menettelyllä varmistua siitä, että juuri nämä tuotteet ovat käyttäjälleen (tai muille sivullisille) turvallisia. Rakennusmateriaalin tulee kestää määritelty kuorma, lelunallen silmä ei saa liian helposti irrota tai aiheuttaa tukehtumisvaaraa, turvavarusteiden on tarjottava liittävä suoja, sähkölaitteiden on oltava käyttäjälleen turvallisia jne. Kaikissa näissä on taustalla myös vastaavanlainen arviointimenettely.
Tämä jrjestelmä on kaikkinensa tasapainoilua liiketaloudellisten ja turvallisuuteen liittyvien seikkojen välillä, mutta kuitenkin niin, että se on rakennettu nimenomaan markkinatalouden ehdoilla. Nyt lääkinnällisiä laitteita koskevan asetusmuutoksen myötä tämä vaaka painuu voimakkaammin sinne turvallisuuden puolelle, mutta edelleenkin järjestelmä on, näiden tuotteiden luonne huomioiden, pikemminkin mahdollistava kuin rajoittava.
CE-järjestelmän takana on siis ensisijaisesti tuotteen turvallisuus, ja vasta toissijaisesti tuotteen teho. Turvallinen, mutta tehoton tuote kun on lopulta vain huonoa bisnestä.
Jos muuten joku kysyy, että mistä niitä CE-merkkejä (Conformité Européene) saa, voitte aivan hyvin vastata, että internetistä, ettekä edes valehtele. Kannattaa kuitenkin olla varuillaan, ettei vahingossa nappaa kiinalaista CE-merkkiä (China Export). Yhdennäköisyys on tuskin sattumaa.

Mikäli tarvitset näissä kiemuroissa apua, mitä hyvänsä, me Kasvella autamme sinua oikein mielellämme. Toimintatapoihimme kuuluu myös se, että jos koemme, ettemme jossain spesifissä kysymyksessä osaa auttaa, kerromme sen avoimesti ja autamme sinua löytämään tarvitsemasi avun jostain muualta. Ota siis rohkeasti yhteyttä!
Hulvattoman hauskaa rekisteröintiä toivotellen,
Elias
PS. Blogisarjan ensimmäisessä osassa keskityttiin tuotteen määrittelyyn. Toinen osa puolestaan käsitteli tuotekohtaisia vaatimuksia ja niiden täyttämistä. Löydät nämä kirjoitukset linkkien takaa!
Elias Haapakorva
Executive Chairman (-10/2023); Head of QARA, Medical Devices
Lue lisää blogistamme
Medical Devices -rekisteröinti ja markkinoille saattaminen for Dummies | Osa 1
Blogisarjan ensimmäisessä osassa keskitytään tuotteen määrittelyyn sekä siihen, miksi se on niin olennaista.
Medical Devices – rekisteröinti ja markkinoille saattaminen for Dummies | Osa 2
Kolmiosaisen blogisarjan toisessa osassa keskitytään tuotetta koskeviin vaatimuksiin ja niiden täyttämiseen.
Terveydenhuollon yksiköiden omavalmistus ja asetus lääkinnällisistä laitteista (MDR)
Lääkinnällisten laitteiden direktiiviin verrattuna uusi asetus (MDR) lisää ja selkeyttää omavalmistukselle asetettuja vaatimuksia. Lue vinkkimme käyttöönottoon.